Définition
Une malformation artérioveineuse cérébrale (MAVc) consiste généralement en un amas de vaisseaux anormaux (le « nidus ») qui s’est formé autour d’un ou de plusieurs shunts entre des artères et des veines au niveau cérébral. Les MAVc peuvent être à l’origine de crises d’épilepsie, de céphalées, de déficit neurologique progressif ou d’hémorragie intracérébrale.
Epidemiologie
Les séries épidémiologiques actuellement disponibles ont permis d’évaluer l’incidence de la découverte d’une MAVc à environ 1,5 cas pour 100.000 habitants par année ce qui correspond à environ 900 patients par an en France métropolitaine.
L’incidence de rupture des MAVc, c’est-à-dire le nb de patients ayant une malformation découverte dans le contexte d’une première hémorragie intracrânienne, est estimée à environ 0.55 /100.000 personnes par année soit plus de 300 patients par an en France.
L’incidence des symptômes associés au MAV non rompues (crise d’épilepsie, céphalées, déficits neurolgiques) reste inconnue
Les MAVc concernent autant les femmes que les hommes, elles sont détectées sans prépondérance ethnique particulière.
Description clinique et pronostic
Les MAVc sont le plus souvent révélées par des crises épileptiques (jusqu’à 60% selon les séries). Ces crises surviennent le plus souvent entre 20 et 40 ans. Une MAVc révélée par une crise après l’âge de 60 ans est très rare. Il s’agit principalement de crises focales simples ou complexes, avec ou sans généralisation secondaire. La survenue de crises épileptiques serait associée à certains aspects morphologiques de la malformation vasculaire (localisation corticale, lobaire ou en zone de jonction, grande taille de la malformation, drainage veineux superficiel). Dans la majorité des cas, les crises sont bien contrôlées sous monothérapie antiépileptique.
Les MAVc sont parfois dévouvertes à l’occasion du bilan d’une céphalée chronique, en absence de toute hémorragie cérébrale (jusqu’à 50% selon les séries). La fréquence des céphalées primaires (crises de migraine, céphalée de tension etc…) n’est cependant pas différente en présence ou en l’absence de MAVc et l’existence d’un lien causal est souvent remis en cause. Dans quelques cas, un lien entre les céphalées du patient et la MAVc apparait plausible en raison, en particulier, du caractère très localisé et unilatéral de la céphalée et de l’absence d’autre cause.
Moins de 10% des patients ont une MAVc découverte à l’occasion d’un déficit neurologique progressif en l’absence de toute hémorragie. Les femmes seraient plus souvent concernées et le risque augmenterait ave l’âge. Les mécanismes à l’origine de ce type d’aggravation demeurent imparfaitement élucidés. L’hypothèse d’un vol artériel symptomatique a été écartée.
Environ 10% des MAVc sont découvertes de façon fortuite à l’imagerie cérébrale en l’absence de tout symptôme.
Enfin, la complication la plus grave est la possibilité d’une rupture spontanée à l’origine d’une hémorragie intracranienne (cérébrale, ventriculaire ou méningée). Les hémorragies intracérébrales peuvent être à l’origine de manifestations neurologiques focales transitoires, persistantes (hémiplégie, troubles du langage, troubles visuels etc…), de crises d’épilepsie, de céphalées ou de troubles de la conscience. Ces symptômes varient en fonction de la localisation de la lésion et de l’étendue de l’hémorragie.
Le pronostic de la maladie est principalement lié à ce risque de rupture. Peu de données prospectives sont disponibles concernant le risque hémorragique à long terme chez des patients ayant une MAVc non traitée. Cependant, il est évalué à environ 1% par an. Le risque de rupture est beaucoup plus élevé après la survenue d’une première hémorragie cérébrale (environ 5 % par an) en particulier lors des 12 premiers mois (jusqu’à 18 % selon les séries). . D’autres facteurs de risque de rupture de MAVc chez les patients non traités ont été identifiés. Il s’agit d’un âge > à 35 ans et de certaines caractéristiques morphologiques de la malformation telles que l’existence d’un drainage veineux profond et sa localisation dans les structures cérébrales profondes.
Physiopathologie
Lésion considérée comme congénitale, une MAVc est caractérisée par l’amas de vaisseaux anormaux (son nidus) développé autour d’un ou de plusieurs shunts arterioveinulaires. L’absence de capillaires à l’interface, au niveau du ou des shunts, diminue la résistance vasculaire et entraîne des perturbations hémodynamiques à différents niveaux : accélération du flux artériel et augmentation du débit sanguin, baisse de la pression au niveau des petites artères cérébrales et augmentation de la pression veineuse en aval de la malformation. Cette altération hémodynamique est à l’origine d’une angiopathie secondaire des vaisseaux impliqués avec formation de dilatations et tortuosités vasculaires, ainsi que dans quelques cas, apparition d’anévrysmes artériels ou de dilatations veineuses.
Diagnostic
Aujourd’hui, le diagnostic de MAVc est le plus souvent facilement réalisé à partir des résultats d’une imagerie par résonance magnétique (IRM) cérébrale complété d’une angiographie par résonance magnétique (ARM), en particulier pour les malformations de diamétre supérieur à 5- 10 mm.
L’artériographie (injection intra-artérielle d’un produit de contraste pour visualiser les vaisseaux du cerveau) demeure cependant la méthode de référence pour le dépistage, la confirmation diagnostique et la caractérisation morphologique d’une MAVc. L’apparition d’une veine précoce (qui s’injecte beaucoup trop tôt au cours de l’angiographie) permet de démontrer la communication directe entre une artère et une veine au sein de la malformation.
Après la survenue récente d’une hémorragie cérébrale, il est parfois nécessaire de répéter à distance l’artériographie cérébrale, pour rechercher une petite malformation vasculaire. La collection hémorragique peut en effet camoufler une petite MAVc et la rendre invisible lors du premier examen.
L’IRM fonctionnelle permettant de cartographier au niveau du cerveau les zones fonctionnelles importantes (moricité, langage par exemple) est parfois utilisée pour évaluer le risque d’une intervention chirurgicale.
Traitement
Pour la prise en charge des MAVc, une approche multidisciplinaire apparait souhaitable.
Le traitement des crises d’épilepsie, la prise en charge des céphalées et la surveillance de l’état neurologique du patient, en particulier de son état cognitif pourront être effectués de préférence par un neurologue spécialisé en pathologie neurovasculaire.
Les traitements curatifs, le choix des techniques et les approches utilisées seront évaluées entre neurochirurgiens et neuroradiologues interventionnels, parfois avec un radiothérapeute.
Le traitement spécifique de la malformation est basé sur l’application d’un ou la combinaison de 3 types de traitements : l’embolisation de la MAVc par voie endovasculaire, l’exérèse chirurgicale, la radiothérapie stéréotaxique. L’objectif de ces traitements dits invasifs est d’éliminer ou de réduire considérablement le risque hémorragique par oblitération partielle ou complète des vaisseaux composant la MAVc.
Le choix thérapeutique s’appuie sur l’état clinique du patient et son histoire (MAVc rompue ou non-rompue, âge, examen neurologique, autre pathologie associée, etc.) et sur la morphologie de la lésion. La décision tiendra parfois compte d’autres facteurs comme la personnalité du patient, la profession, l’aide et le soutien de l’entourage.
La décision thérapeutique est basée sur l’estimation du risque hémorragique spontané sans traitement et le risque du traitement invasif. Il est donc évalué au cas par cas. Généralement, lorsque la MAVc est considérée comme à haut risque de rupture, le traitement le plus complet possible de la MAVc est préférable car tout traitement partiel impose au patient le risque de l’intervention sans éliminer le risque d’une future rupture. C’est le cas des MAVc déjà rompues qui sont à haut risque de récidive hémorragique. Lorsque le risque de rupture est estimé très faible, une simple surveillance neurologique sans intervention peut être justifiée. Ainsi, pour les MAVc non-rompues, les résultats d’une étude comparative randomisée de méthodologie solide (étude ARUBA : A Randomized Trial of Unruptured Brain AVMs ) sont très nettement en faveur d’une prise en charge médicale sans intervention. Après un suivi en moyenne égal de plus de 2 ans et demi, la survenue d’une hémorragie cérébrale ou d’un décès était 3 fois plus fréquentes dans le groupe de patients ayant eu un traitement interventionnel (30 %) que dans le groupe de patients ayant eu une prise en charge médicale (10 %).
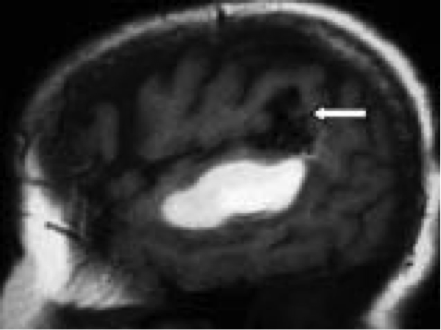
(a) L’IRM en pondération T1 montre un hématome temporal gauche en hypersignal. Le nidus de la malformation est visualisée à proximité de l’hémorragie (flèche).
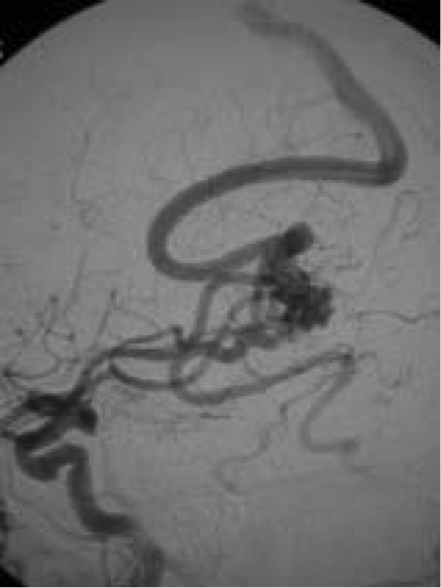
(b) L’artériographie carotide confirme une MAVc alimentée par des branches corticales de l’artère cérébrale moyenne